
Статьи


Актуальные представления о механизмах аллергенспецифической иммунотерапии, потенциальных маркерах эффективности и путях совершенствования
09.03.2022
Ключевые слова:
Аллерген-специфическая иммунотерапия (АСИТ), Международный консенсус, механизмы АСИТ, биомаркеры, маркеры эффективности, аллергия, иммунотерапия, будущее АСИТ, аллерговакцина, аллергические заболевания, аллергический ринит, аллергический конъюнктивит, бронхиальная астма
В статье анализируются международные позиционные документы, посвященные механизму аллергенспецифической иммунотерапии (АСИТ), обсуждаются потенциальные биомаркеры эффективности АСИТ, а также перспективы ее развития.
Введение
За последние 20 лет достигнуты значительные успехи в понимании молекулярных и клеточных механизмов аллергической толерантности, которая развивается в результате успешной аллерген-специфической иммунотерапии (АСИТ). Иммунная толерантность к аллергенам может быть определена как установление долговременной клинической невосприимчивости к аллергенам, которые больше не вызывают развитие аллергических симптомов, что иммунологически подразумевает изменения в ответах аллерген-специфических Tи B-клеток памяти и повышение порога активации тучных клеток и базофилов [1–5]. Кроме того, основными клиническими проявлениями иммунной толерантности являются профилактика сенсибилизации к новым аллергенам [6] и прогрессирования заболевания до более тяжелых форм (в том числе развитие астмы) [7].
Иммунный ответ при IgE-опосредованных реакциях
Иммунологическая основа аллергических заболеваний определяется в два этапа: 1) сенсибилизация и развитие Tи B-клеток памяти и продукция IgE (ранняя фаза); 2) эффекторные функции, связанные с воспалением и повреждением тканей (поздняя фаза) [3]. Дифференцирование и клональная пролиферация специфичных к аллергену CD4+ Th2-клеток, продуцирующих IL-4 и IL-13, имеют важное значение для индуцирования переключения синтеза на тяжелую цепь e-иммуноглобулина в }-клетках и продуцирования аллерген-специфических IgE во время фазы сенсибилизации. Аллерген-специфический IgE связывается с высокоаффинным FceRI на поверхности тучных клеток и базофилов, что приводит к сенсибилизации пациента [8]. Когда новое взаимодействие с аллергеном вызывает сшивание комплексов IgE-FceRI на сенсибилизированных базофилах и тучных клетках, они активируются, и затем высвобождаются анафилактогенные медиаторы, ответственные за классические симптомы немедленной фазы (гиперчувствительность 1-го типа). В зависимости от активирующей врожденный иммунный ответ способности веществ, совместно экспонированных с антигеном, состояния клеток, ко-сигналов для дифференцировки клеток и цитокинов в микроокружении наивные Т-клетки CD4+ могут дифференцироваться в Th1, Th2, Th9, Th17 или клетки памяти типа Th22 или эффекторные клетки. На основе их соответствующих профилей цитокинов, ответов на хемокины и взаимодействия с другими клетками эти подмножества T-клеток могут способствовать различным типам воспалительных реакций. Во время развития аллергического заболевания IL-4, IL-5, IL-9, IL-13, продуцируемые эффекторными Th2-клетками [1–3, 9, 10], и, возможно, другие недавно идентифицированные цитокины, такие как IL-25, IL-31, IL-33, секретируемые главным образом эпителиальными и дендритными клетками (ДК), способствуют Th2-ответу [11–17]. Эти цитокины играют определенную роль в производстве аллерген-специфических IgE, эозинофилии, повышенной проницаемости эндотелия для рекрутирования воспалительных клеток в воспаленные ткани, продуцирования слизи и уменьшении порога сокращения гладкой мускулатуры [18]. Обычно наблюдаемый профиль Th2 при атопических заболеваниях может быть результатом:
a) усиленной дифференцировки и клональной пролиферации Th2-клеток [19] или б) повышенной склонности к индуцированной активацией гибели высокопродуцирующих IFN-g Th1-клеток [20, 21]. Открытие Th17-клеток заполняет существенный пробел в понимании воспалительных процессов. Th17 характеризуются экспрессией IL-17A, IL-17F, IL-6, IL-8, TNF-a, IL-22 и IL-26 [22–28]. Нейтрализация IL-17 и связанных с Th17 функций приводит к разрешению патологических процессов в тканях в моделях аутоиммунных заболеваний, уменьшает разрушение суставов при экспериментальном артрите и уменьшает нейтрофильную инфильтрацию в экспериментальной модели астмы [29–32]. В двух недавних исследованиях показано, что TGF-}в присутствии IL-4 перепрограммирует дифференцировку Th2-клеток и приводит к развитию новой популяции Th9-клеток, продуцирующих IL-9 и IL-10 [33, 34]. Субпопуляция Th22-клеток характеризуется экспрессией IL-22 с низким уровнем экспрессии IL-17 и играет роль в патогенезе атопического дерматита [35].
Все эти субпопуляции Т-клеток и связанные с ними события представляют собой мишени при лечении аллергических заболеваний, а индукция регуляторных клеток (Тreg) и толерантность к аллергенам могут сбалансировать их активацию.
В течение последних 15 лет продемонстрирована ключевая роль Treg в индуцировании и поддержании иммунной толерантности, когда было показано, что их адаптивная передача предотвращает или оказывает лечебное действие в нескольких моделях Т-клеточно-опосредованных заболеваний, включая астматическое воспаление легких, аутоиммунные заболевания и отторжение аллотрансплантата [36]. Популяция Treg неоднородна, изучено несколько типов: адаптивные (естественно встречающиеся) Treg CD4+CD25+FoxP3+, экспрессирующие транскрипционный фактор 3 семейства forkhead (FoxP3) и Treg 1-го типа CD4+CD25+FoxP3–, продуцирующие IL-10 [37]. Транскрипционный фактор FoxP3 в отличие от других представителей подсемейства cпецифичен только для клеток иммунной системы и выявляется в CD4+CD8–CD25+ тимоцитах, а также необходим для дифференцировки и последующей реализации функций CD4+CD25+ Treg [38]. В то же время имеются данные о кратковременной экспрессии FoxP3 в эффекторных Т-клетках, уровень которой несопоставимо меньше по сравнению с Treg [39]. В реализации иммунных реакций имеет значение не количество FoxP3, а организация молекулы FoxP3. На сегодняшний день достоверно известно наличие специфических участков – CNS (conserved non-coding DNA sequence) – в структуре FoxP3. Предполагается, что они содержат информацию, регулирующую основные функции FoxP3. Доказано, что каждый из них отвечает за выполнение определенной функции. Так, CNS1 регулирует дифференцировку Тreg и содержит TGF-}–NFAT-связывающий компонент. CNS2 регулирует экспрессию FoxP3 в развивающихся Treg. CNS3 связывается с Rel-белками и влияет на возрастание количества Тreg в тимусе [40]. В то же время до сих пор не существует точного представления о структуре гена FoxP3. Регуляторные Т-клетки характеризуются экспрессией IL-10, TGF-} и IL-35 [41]. Показано, что FoxP3 клетки подавляют воспаление в легочной ткани, индуцированное Th17: обнаружена негативная корреляция между числом FoxP3 Treg в периферической крови и уровнем IL-17 при воспалительных процессах [42–44]. При изучении молекулярной структуры установлено, что у мышей фактор FoxP3 существует в единственной форме, а у человека описано по крайней мере четыре изоформы данной молекулы, одна из которых является полномасштабной, а три другие формируются в результате альтернативного сплайсинга с делецией отдельно экзонов 2, 7 или одновременно 2 и 7 [45–48]. Экзон 2 кодирует домен молекулы FoxP3, ответственной за связывание транскрипционных факторов семейства ROR – a и g. Одна из функций этих факторов – индукция дифференцировки Th17-клеток [49, 50]. Экзон 7 кодирует последовательность, ответственную за димеризацию молекулы [48]. Еще одной особенностью молекул FoxP3 с делецией продуктов экзонов 2 и 7 в отличие от полномасштабной молекулы является их преимущественная локализация внутри ядра вследствие утери одной из двух последовательностей, отвечающих за экспорт из ядра (nuclear export sequences – NE Ss), расположенных в областях, кодируемых экзонами 1/2 и 6/7 соответственно [51, 52]. В этой же работе показано, что при активации наивных CD25–CD4+ T-клеток экспрессия FoxP3 определяется в основном в цитоплазме в отличие от преимущественной локализации внутри ядра у CD25+CD4+ Treg. С точки зрения функционирования FoxP3 в качестве транскрипционного активатора и супрессора представляется весьма важным его нахождение внутри ядра [52]. В настоящий момент изучение структуры FoxP3 продолжается.
Здоровый иммунный ответ изучался на моделях высокой экспозиции аллергенов у пчеловодов и владельцев кошек. Treg, специфичные для общих аллергенов окружающей среды, представляли доминирующее подсемейство у здоровых лиц. Treg используют множественные подавляющие механизмы: секрецию IL-10 и TGF-}, цитотоксический Т-лимфоцитарный антиген 4 и поверхностную молекулу программированной смерти 1. Здоровые индивидуумы и лица, страдающие аллергией, имеют все три субпопуляции аллерген-специфических Т-клеток – Th1, Th2 и Treg 1-го типа, но в разных пропорциях [41]. Соответственно изменение доминантного подмножества и баланс между клетками Th2 и Treg могут приводить либо к развитию аллергии, либо к выздоровлению.
Толерантность к аллергенам у здоровых людей может быть нарушена при определенных условиях. В недавнем исследовании изучались миндалины человека, которые содержат аллерген-специфические Т-клетки, но демонстрируют очень низкий уровень пролиферации Т-клеток, вызванной аллергеном, что представляет собой очень подходящую модель in vivo для оценки механизмов нарушения аллерген-специфической Т-клеточной толерантности [53, 54]. Было продемонстрировано, что стимуляция миелоидных дендритных клеток IL-1}, IL-6, Toll-подобного рецептора (TLR) 4 TLR4 и TLR8 нарушает аллерген-специфическую толерантность CD4+ Т-клеток через механизм, зависящий от MyD88 [Myeloid differentiation primary response gene (88)] – цитозольный адаптерный белок, один из пяти белков, участвующих в передаче сигнала от TLR, участвует в функционировании всех Toll-подобных рецепторов за исключением TLR3) [53].
В частности, миелоидные дендритные клетки (ДК) и факторы, которые активируют их, нарушают толерантность к аллерген-специфическим CD4-T-клеткам, тогда как плазмоцитоидные ДК и факторы, которые активируют их, такие как TLR7 и TLR9, не оказывают никакого эффекта. Состояния с нарушенной толерантностью, вызванные различными молекулярными механизмами, были связаны со смешанным профилем цитокинов с тенденцией к увеличению уровней IL-13 и IL-17, которые являются цитокинами T2 и T17 соответственно [53]. Вирусные инфекции могут играть роль в нарушении иммунной толерантности посредством вышеупомянутых или других молекулярных механизмов [54, 55]. Инфицирование эпителия дыхательных путей риновирусом может противодействовать толерантности к вдыхаемому антигену посредством комбинированной индукции тимусного стромального лимфопоэтина (TSLP), IL-33 и лиганда OX40 [56].
В дополнение к Treg в подавлении иммунного ответа играют IL-10-продуцирующие регуляторные B-клетки (Breg). Индуцируемые IL-10-секретирующие Breg 1-го типа экспрессируют высокий уровень поверхностных CD25 и CD71 и низкие уровни CD73. CD73–CD25+CD71+. Breg 1-го типа продуцируют высокий уровень IL-10 и способны подавлять антиген-специфическую пролиферацию CD4+ Т-клеток [57]. Эти клетки показали значительное снижение уровней провоспалительных цитокинов (TNF-a, IL-8 и макрофагальный воспалительный белок 1-a), а также увеличили производство противовоспалительного антагониста рецептора IL-1 и фактора роста эндотелия сосудов. Кроме того, экспрессирующие IL-10 В-клетки секретировали меньше IgE и сильно подавляли провоспалительные цитокины (TNF-a, IL-8), способствовали созреванию ДК, полученных из моноцитов (превращение их профиля в регуляторный фенотип), и антиген-специфической пролиферации [58].
Врожденные лимфоидные клетки (innate lymphoid cells – ILC) представляют собой недавно введенную субпопуляцию клеток, которые могут играть роль в усилении воспаления при многих заболеваниях. В частности, ILC 2-го типа играют роль в развитии астмы и воспаления верхних дыхательных путей [59]. Th2-иммунный ответ характеризуется GATA-3+ ILC2s, TC2-клеток и Th2-клеток, продуцирующих IL-4, IL-5 и IL-13, которые индуцируют активацию тучных клеток, базофилов и эозинофилов, а также продукцию антител изотипа IgE, защищая от гельминтов и ядов [60].
Множественность эффектов АСИТ
Иммунный ответ в ходе проведения АСИТ включает ряд сложных механизмов. На его формирование влияют структурные особенности и доза аллергена, путь и время его воздействия, наличие стимуляторов врожденного иммунного ответа в аллергене и микросреде, а также генетическая предрасположенность организма-хозяина [61–64]. Эффективная АСИТ последовательно активирует несколько механизмов (см. рисунок), что в идеале приводит к разностороннему клиническому улучшению. В зависимости от протокола АСИТ десенсибилизация к аллергену, антиген-специфическая иммунологическая толерантность и супрессия аллергического воспаления развиваются в течение нескольких часов. Далее следуют генерация аллерген-специфических регуляторных T-лимфоцитов (Treg) и регуляторных B-лимфоцитов (Breg), регуляция аллерген-специфических IgE и IgG4, а также развитие иммунной толерантности (см. рисунок, A). АСИТ, в частности, воздействует на иммунные клетки II типа, включая Th2-лимфоциты, незрелые лимфоидные клетки (ILC2) 2-го типа и цитотоксические Т-лимфоциты 2-го типа, которые продуцируют IL-4, IL-5 и IL-13, индуцирующие активацию тучных клеток, базофилов и эозинофилов, а также выработку антител изотипа IgE (см. рисунок, Б) [60, 65].
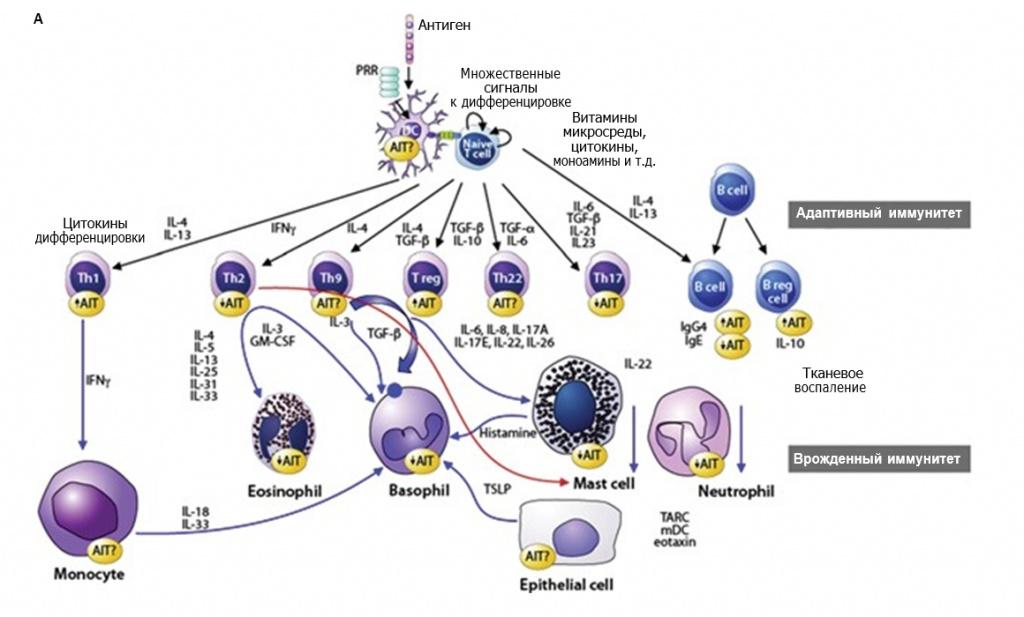
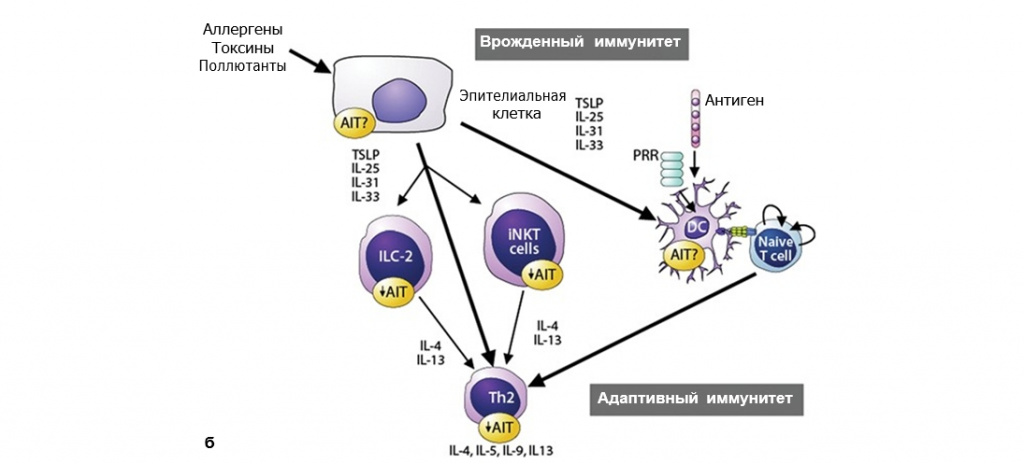
Рисунок. А Клеточные и молекулярные изменения при АСИТ (по [61]). А. Дифференцировка необученных Т-лимфоцитов после презентации аллергена в присутствии веществ врожденного иммунного ответа, которые приводят в действие рецепторы распознавания структур (РRR), а также витаминов, моноаминов, которые контролируют клеточную дифференцировку, и веществ, оказывающих воздействие совместно с антигеном; показано состояние клеток и цитокинов в микросреде. Необученные Т-лимфоциты могут дифференцироваться в Th1-, Th2-, Th9-, Th17и Th22-лимфоциты. Учитывая их соответствующие цитокиновые профили, ответы на хемокины, а также взаимодействия с другими клетками, эти субпопуляции Т-лимфоцитов могут вносить вклад в общее воспаление. Увеличение количества Th1и Treg-лимфоцитов играет определенную роль в уравновешивании других эффекторных клеток. Баланс между аллерген-специфическими эффекторными Т-лимфоцитами (особенно Th2) и Treg-лимфоцитами, продуцирующими IL-10, имеет решающее значение для развития или супрессии аллергического воспаления. Treg-лимфоциты и их цитокины подавляют иммунные ответы Th2-типа и способствуют контролю аллергических заболеваний несколькими основными способами. Аналогичным образом индукция Breg-лимфоцитов, продуцирующих IL-10, играет важную роль в подавлении IgE и индукции IgG4. TARC – хемокин, регулируемый тимусом и активацией; TSLP – тимусный стромальный лимфопоэтин; mDC – хемокин макрофагального происхождения.
Рисунок. Б. Клеточные и молекулярные изменения при АСИТ. Супрессия периферических ILC, особенно ILC 2-го типа, может способствовать супрессии Th2-лимфоцитов и иммунологической толерантности, индуцированной АСИТ. iNKT – инвариантный натуральный Т-киллер; TSLP – тимусный стромальный лимфопоэтин
Ранняя десенсибилизация
Хотя снижение уровней антител изотипа IgE и IgE-опосредованной кожной чувствительности к аллергену обычно требует несколько лет проведения АСИТ, большинство пациентов с инсектной аллергией становятся защищенными от ужаления пчелами уже после первых инъекций, что обусловлено ранним снижением подверженности тучных клеток и базофилов к дегрануляции [66, 67]. Мало информации о механизмах, с помощью которых АСИТ модифицирует и/или подавляет иммунные ответы базофилов и тучных клеток, в частности при повторном введении возрастающих доз аллергенов в первые часы. Хотя это похоже на быструю десенситизацию при гиперчувствительности к лекарственным средствам, механизм этого эффекта десенсибилизации для АСИТ пока неизвестен [68]. Предложено несколько механизмов, объясняющих данный эффект. Одним из основных медиаторов, высвобождаемых эффекторными клетками, является гистамин, действие которого опосредуется взаимодействием с гистаминовыми рецепторами (ГР). До настоящего времени идентифицировано 4 типа ГР [69]. Стимуляция ГР 1-го типа оказывает провоспалительное действие, в то время как ГР 2-го типа, как было показано, сопряжен с аденилатциклазой и фосфоинозитидными системами второго мессенджера. Предполагается, что он в основном участвует в толерогенных иммунных ответах [70]. При проведении АСИТ ядом пчел в течение 6 ч фазы наращивания дозы наблюдалось быстрое повышение экспрессии ГР 2-го типа, которое подавляло индуцированную FceRI активацию и высвобождение медиаторов базофилов [71]. В то же время ГР 2-го типа обладают сильным иммунорегулирующим действием на Т-лимфоциты, ДК и базофилы [72]. Кроме того, после АСИТ отмечается значительное повышение экспрессии диаминоксидазы базофилами, что предлагается в качестве нового биомаркера АСИТ [73]. В целом тучные клетки и базофилы экспрессируют множество мишеней, которые в будущем позволят повысить эффективность АСИТ, а также осуществлять разработку новых биомаркеров [74, 75].
Толерантность Т-лимфоцитов
АСИТ вызывает значительные изменения субпопуляций аллерген-специфических Т-клеток. Доля Th2-лимфоцитов, секретирующих IL-4, уменьшается; тем временем количество секретирующих IL-10 индуцибельных Treg-лимфоцитов, специфичных в отношении того же аллергенного эпитопа, увеличивается, их функция начинает соответствовать иммунному статусу, наблюдаемому у здоровых лиц без аллергии. Это, как представляется, является одним из ключевых этапов в развитии периферической толерантности к аллергенам [63, 76]. Существует значительная корреляция между уменьшением симптомов и увеличением количества индуцибельных Treg-лимфоцитов во время иммунотерапии [77, 78]. Исследования, в которых изучали роли различных типов Treg-лимфоцитов при проведении АСИТ, показали перекрывающиеся эффекты различных субпопуляций Treg-лимфоцитов (адаптивных Treg, экспрессирующих FoxP3 CD4+CD25+FoxP3+, и Treg 1-го типа CD4+CD25+FoxP3–, продуцирующих IL-10) в индукции Т-клеточной толерантности [79, 80].
Толерантность В-лимфоцитов
Фенотипическая экспрессия Breg-лимфоцитов играет определенную роль в аллергических заболеваниях. У пациентов с инсектной аллергией после АСИТ ядом пчел, так же как и у пчеловодов с толерантностью к пчелиному яду, обнаруживаются секретирующие IL-10 аллерген-специфические CD73–CD25+CD71+ Breg 1-го типа с супрессивным действием на антиген-специфические CD4+ Т-лимфоциты и способностью специфически продуцировать IgG4 [57]. Эта работа поддерживается данными, показывающими, что гиперэкспрессии IL-10 в B-лимфоцитах человека достаточно для индукции регуляторной роли В-лимфоцитов [58]. В дополнение к прямой роли Breg-лимфоцитов IL-10, образованный в Treg-лимфоцитах, стимулирует переключение B-лимфоцитов на секрецию антител изотипа IgG в присутствии IL-4, в то время как один IL-4 индуцирует продукцию IgE [81]. В-лимфоциты человека способны регулировать пластичность CD4+ Т-лимфоцитов для обеспечения гибкости ответа с участием эффекторных Т-лимфоцитов [82]. Будучи толерогенным антителом, аллерген-специфическая молекула IgG4 конкурирует с аллерген-специфическим IgE с такой же специфичностью связывания с аллергеном, тем самым предотвращая высвобождение медиаторов из тучных клеток и базофилов. Существует также возможность образования комплексов IgE-аллерген-IgG4, которые связываются с FcgRIIb и FceRI, ингибируя рецептор IgE [83]. Антитела изотипа IgG4 с различной специфичностью могут обмениваться своими тяжелыми цепями иммуноглобулинов в рамках процесса, называемого обменом Fab-фрагментов. Этот процесс приводит к образованию биспецифических, функционально моновалентных антител изотипа IgG4, которые не в состоянии перекрестно связывать аллергены [84]. Кроме того, IgG4 не в состоянии фиксировать компоненты комплемента и имеет ограниченную аффинность для активации Fcg-рецепторов [85]. Известно, что АСИТ индуцирует преходящее повышение уровня IgE в сыворотке в начале курса лечения, несмотря на свою защитную клиническую эффективность.
Биомаркеры АСИТ
Исходя из современных представлений о механизмах АСИТ, был предложен ряд показателей – кандидатов для оценки (прогноза) эффективности АСИТ [89]. Все они были разделены на 7 доменов:
-
IgE: уровень общего (total) IgE (tIgE), fkkthuty-специфического (allergen specific) IgE (asIgE) и соотношение аsIgE/tIgE;
-
IgG субклассы (специфические к аллергену аsIgG1, аsIgG4, включая соотношение аsIgE/ аsIgG4);
-
инактивирующая активность сыворотки для IgE [IgE-facilitating allergen binding (IgE-FAB) и IgEbinding factor (IgE-BF)];
-
активация базофилов;
-
цитокины и хемокины;
-
клеточные маркеры (Т-регуляторные клетки, В-регуляторные клетки, ДК);
-
in vivo биомаркеры (включая провокационные тесты).
1-й домен.
IgE (уровень tIgE, аsIgE и соотношение sIgE/tIgE). Очевидным достоинством является то, что этот маркер определяется в сыворотке; уровень аsIgE является «золотым стандартом» для отбора пациентов для проведения АСИТ; отмечается повышение уровня во время наращивания дозы и аллергенной экспозиции; в нескольких исследованиях было показано, что соотношение аsIgE/tIgE может быть потенциальным положительным прогностическим маркером для АСИТ. С другой стороны, значительный рост аsIgE, который отмечается в течение ранней фазы АСИТ, не имеет клинической и функциональной значимости; соотношение аsIgE/ tIgE не было оценено в рандомизированных двойных слепых плацебо-контролируемых исследованиях (РДCПКИ). В одном ограниченном РДCПКИ не была подтверждена зависимость клинических исходов и соотношения аsIgE/tIgE. Кроме того, различные методологические платформы могут использоваться для определения соотношения аsIgE/ tIgE, хотя эквивалентность между единицами измерения для tIgE IU/ml (kU/l) и единицами для аsIgE (kUa/l) была продемонстрирована только для одной методологической платформы. Таким образом, требуется больше РДCПКИ, где будет оцениваться возможность прогностического использования аsIgE/tIgE как биомаркера в сопоставлении с клиническими исходами. Предлагается в дополнение исследовать локальную продукцию аsIgE/tIgE в зависимости от клинической значимости, а также стандартизировать методологические платформы для определения аsIgE/tIgE [89].
2-й домен.
Субклассы IgG (специфические к аллергену аsIgG1, аsIgG4, включая соотношение аsIgE/ аsIgG4). Достоинством является то, что этот маркер определяется в сыворотке; были опубликованы согласованные результаты для подкожной и сублингвальной АСИТ, оценивающие концентрацию аsIgG4. Было показано, что «блокирующие» IgG4 сыворотки способны подавлять как аллерген-индуцированное высвобождение гистамина, так и связывание комплексов IgE-аллерген с В-клетками. Недавние исследования показали, что метод иммунохемилюминесценции (ИХЛ) на иммунном твердофазном аллергочипе (ISAC) может быть использован для определения блокирующей способности аsIgG4 при АСИТ. Корреляция между уровнем аsIgG4 и клиническими исходами была продемонстрирована во многих, но не во всех клинических исследованиях. При изучении долгосрочного эффекта после прекращения АСИТ в течение 6 лет не было выявлено соответствующей корреляции. Таким образом, низкий уровень аsIgG4 может быть потенциально негативным маркером; недостаток аsIgG4 может также быть индикатором неадекватного комплаенса. Предлагается в дополнение исследовать локальную продукцию аsIgG4 в зависимости от клинической значимости, а также другие подклассы IgG, IgD и IgA [89].
3-й домен.
Инактивирующая активность сыворотки для IgE (IgE-FAB и IgE-BF) обусловлена главным образом фракциями IgA и IgG и заключается в предотвращении связывания аллергена с IgE (IgE-BF), связывания комплекса аллерген-IgE с B-клетками (IgE-FAB) и в подавлении дегрануляции базофилов. IgE-блокирующий фактор (IgEBF) – это степень (мера), до которой несколько факторов могут препятствовать связыванию IgE с соответствующим аллергеном и таким образом предотвращать аллергенный ответ и клинические симптомы. Определение этого эффекта доступно при использовании твердофазных методов (ИХЛ). Несколько исследований подтвердили связь между повышением уровня IgE-BF c клиническими исходами. Определение IgE-BF выполнялось на оборудовании Advia Centaur, которое больше не производится. IgE-FAB – высоковоспроизводимый метод, основанный на проточной цитометрии, использующий определение связывания комплекса аллерген-IgE с В-клетками, экспрессирующими поверхностный низкоаффинный рецептор для IgE – FceRII (CD23). В нескольких исследованиях показано снижение IgE-FAB после проведения АСИТ, что коррелировало со снижением выраженности клинических симптомов и потребностью в симптоматической медикаментозной терапии. Хотя данные методы воспроизводимы, они могут быть ограничены специализированными центрами и лабораториями. Недавно в качестве альтернативы предложено использование для этого иммуноферментного анализа (ELIFAB). Предполагается, что будущие исследования подтвердят возможность использования IgE-FAB в качестве прогностического биомаркера АСИТ [89].
4-й домен.
Активация базофилов. Достоинством метода является то, что in vitro активация базофилов сенсибилизирующим аллергеном отражает FceRI-опосредованный in vivo ответ; требуется небольшое количество крови для выполнения теста (менее 2 мл). Разноречивые данные получены в ДСПКИ в отношении изучения активации базофилов. Возможно, это связано с изучением различных методов АСИТ (при подкожном методе было отмечено большее влияние на снижение активации базофилов, чем при сублингвальном методе), а также различных маркеров, используемых для теста. Наиболее часто используется CD63 и CD203c, реже CD13, CD107a и CD164. Появление новой технологии обратного окрашивания для оценки активации базофилов подразумевает измерение с использованием проточной цитометрии внутриклеточной фикоэритрин-конъюгированной диаминоксидазы (DAO), которая определяет внутриклеточный гистамин. Результат дегрануляции базофилов, оцениваемый по снижению внутриклеточной DAO, соответствует высвобождению гистамина из клетки. Недостаточно результатов РДCПКИ, оценивающих активацию базофилов. Техническими особенностями метода являются факторы сыворотки, влияющие на жизнеспособность базофилов. Таким образом, требуется разработка стандартизованных методов, регламентирующих выбор базофилов, маркеров активации и продуктов высвобождения из базофилов [89].
5-й домен.
Цитокины и хемокины. Эти методы основаны на понимании механизмов АСИТ, ведущих к подавлению секреции Th2-цитокинов (IL-4, IL-13, IL-9), воспалительных цитокинов и хемокинов, таких как IL-17, эотаксин или ТNF-a и повышению секреции Th1-цитокинов (IFN-g и IL-12) и регуляторных цитокинов (IL-10, TGF-}). В нескольких исследованиях изучалось изменение продукции других хемокинов и других сывороточных маркеров в ходе АСИТ: С-С-рецептор хемокина тип 3 [C-C chemokine receptor type 3 (CCR3, или CD193)] – без изменений; С-С-рецептор хемокина тип 4 [C-C chemokine receptor type 4 (CCR4, или CD194)] – повышение; адипонектин – без изменений; аполипопротеин А-IV – повышение; }-тромбоглобулин – без изменений; С3а и С5а факторы комплемента – снижение; С4а – повышение; эозинофильный катионный белок [eosinophil cationic protein (ECP)] – без изменений; эотаксин – разноречивые данные; растворимые молекулы HLA – без изменений; лептин – без изменений или повышение; сигнальная молекула активации лимфоцитов – повышение; хемокин, регулируемый тимусом и при активации [thymus and activation regulated chemokine (TARC, или CCL17)], – повышение; цитокин семейства факторов некроза опухоли, лиганд, вызывающий апоптоз [TNF-related apoptosis-inducing ligand (TRAIL, или TNFSF10)], – снижение; транстиретин – повышение; триптаза – без изменений. Важно, что ни один из этих маркеров не показал корреляции с клиническим ответом. На сегодняшний день цитокины и хемокины не рассматриваются как биомаркеры. В то же время назальные цитокины могут быть маркерами иммунологического ответа. Цитокины, секретируемые эпителиальными клетками, могут лучше отражать состояние воспаления [89].
6-й домен.
Клеточные маркеры. Тreg играют ключевую роль в иммунологическом процессе при АСИТ, переключая Th2-ответ на Th1-ответ. Также отмечены изменения в переключении аллерген-специфических }-клеток в направлении Вreg и поляризации ДК. Однако не существует специфических маркеров для Treg (сложные методы используются в экспериментальных исследованиях и не могут быть применены в рутинной практике). Число аллерген-специфических Treg и Breg слишком мало, и уловить их изменения технически невозможно в обычной клинической практике. Хотя Breg могут быть охарактеризованы, их определение требует тонких экспериментальных подходов, что также затруднительно в рутинной практике. Экспрессия нескольких маркеров, ассоциированных с ДК, характерна также для других подтипов лейкоцитов (Т-клетки, NK). На сегодняшний день ни Treg, ни Breg не могут быть использованы как биомаркеры для мониторинга АСИТ. Однако они могут быть использованы при разработке лечебных аллергенов как маркеры иммунологического ответа. Требуются дальнейшие исследования на большой когорте пациентов с использованием различных лечебных аллергенов и методов АСИТ. Также интересно изучить влияние АСИТ на миелоидные и плазмацитоидные ДК в крови и в тканях [89].
7-й домен.
In vivo биомаркеры. Провокационные тесты часто используются в клинической практике для оценки аллерген-специфической реактивности пациента и могут демонстрировать изменение чувствительности пациента к аллергену после АСИТ. В провокационной камере имеется возможность создать условия с заданной концентрацией причинно-значимого аллергена в воздухе. Это позволяет стандартизировать процедуры провокационного теста для всех пациентов на различных этапах проведения АСИТ в отличие от природных сезонных колебаний концентраций пыльцы в воздухе в условиях естественной экспозиции причинно-значимого аллергена. Европейское медицинское агентство (ЕМА) рекомендует проведение провокационных тестов для оценки эффективности АСИТ при исследовании различных доз лечебных аллергенов (на II фазе клинических исследований).
Провокационные тесты имеют свои недостатки, такие как риск развития системных реакций, субъективность оценки конъюнктивального провокационного теста и отсутствие стандартизованных методов оценки назальной обструкции, ограниченная доступность провокационной камеры. Внутрикожные тесты не обязательно коррелируют с улучшением состояния пациентов. Провокационные тесты могут и должны использоваться на II и III фазах клинических испытаний, могут помочь понять роль вышеперечисленных биомаркеров в оценке эффективности АСИТ. В то же время провокационные тесты не могут отменить оценки выраженности симптомов при естественной экспозиции в сезон и учета потребности в медикаментах [89].
Таким образом, на современном этапе не существует достаточной доказательной базы для какого-либо предполагаемого биомаркера, динамика которого во время проведения АСИТ коррелировала бы с клиническими симптомами и отражала эффективность АСИТ. Согласно рекомендациям Европейской Ассоциации Аллергологов и Клинических Иммунологов, единственным возможным способом оценки эффективности АСИТ остается определение выраженности клинических симптомов и потребности в медикаментозной терапии для снятия симптомов до и после проведения терапии (табл. 1).
Будущее АСИТ
Последние достижения в области иммунологии и биоинженерии позволяют вносить текущие изменения в АСИТ [64, 91]. Тем не менее уровень качества имеющихся доказательных данных, касающихся этих достижений, может варьировать и включать концептуальные исследования на экспериментальных моделях, клинические исследования по доказательству концепции с ограниченным количеством участников и крупномасштабные многоцентровые клинические исследования.
Наиболее перспективные подходы к повышению эффективности и безопасности АСИТ на основе вакцин включают обход связывания IgE и воздействие на аллерген-специфические Tи B-лимфоциты гипоаллергенными рекомбинантными производными аллергенов и иммуногенными пептидами, использование новых адъювантов и стимуляторов врожденного иммунного ответа, связывание аллергенов с модификаторами иммунного ответа и пептидными белками-переносчиками, а также новые пути введения вакцин [53, 92, 93] (табл. 2). Аналогичные подходы используются при проведении АСИТ при пищевой аллергии. Достигнут некоторый прогресс в разработке АСИТ, включающей 3 основные формы лечения: пероральная иммунотерапия, сублингвальная и накожная иммунотерапия [94].
Таблица 1. Рекомендации Европейской Ассоциации Аллергологов и Клинических Иммунологов по определению среднего балла выраженности назальных и конъюнктивальных симптомов и потребности в медикаментозной терапии для снятия симптомов [90]
|
А) Шкала симптомов |
|||
|
Назальные симптомы |
Зуд в полости носа |
0–3 |
|
|
|
Чихание |
0–3 |
|
|
|
Ринорея |
0–3 |
|
|
|
Заложенность носа |
0–3 |
|
|
Конъюнктивальные симптомы |
Зуд/покраснение глаз |
0–3 |
|
|
|
Слезотечение |
0–3 |
|
|
Средний балл дневных симптомов (TSS) |
0–3 |
||
|
B) Шкала медикаментов |
|||
|
|
Пероральные и/или топические (неседативные Н1 антигистаминные (Н1А) |
1 |
|
|
|
Интраназальные кортикостероиды (ИНК) с/или без H1A |
2 |
|
|
|
Системные кортикостероиды с/или без ИНК, с/или без H1A |
3 |
|
|
Средний балл дневной потребности в медикаментах (MS) |
0–3 |
||
|
С) Комбинированная шкала симптомов и медикаментов |
|||
|
CSMS |
TSS (0–3) + MS (0–3) |
0–6 |
|
Таблица 2. Основные пути совершенствования АСИТ
|
|
Клонирование белков аллергенов и генная инженерия позволили получить вакцины, которые имеют четко определенные молекулярные, иммунологические и биологические характеристики, а также модифицированную молекулярную структуру (фрагменты аллергена, продукты слияния, гибриды и химеры) [92, 93]. Эти подходы открывают возможность усиления толерогенного сигнала, зависимого от Т-лимфоцитов, на фоне применения более высоких доз препарата при низком риске анафилаксии. Клинические исследования рекомбинантных препаратов на основе аллергенов, главным образом пыльцы трав, березы, а также клещей домашней пыли, показали их хорошую лечебную эффективность в сравнении с плацебо. Тем не менее, поскольку они не оказывают значимо лучших эффектов в сравнении с натуральными экстрактами, фармацевтическая промышленность прекратила разработку из-за высокой стоимости и затрат на лицензирование вакцин [95, 96]. Крупные многоцентровые клинические исследования пептидных вакцин против аллергии на кошек и березу в настоящее время находятся в стадии реализации.
Применение более мощных адъювантов может быть более простым и экономически обоснованным. Детоксифицированный ЛПС (монофосфорилированный липид A), олигонуклеотиды CpG, имидазохинолины и производные аденина (все они активируют врожденный иммунный ответ) являются наиболее подходящими кандидатами на использование в аллергической вакцинации, более эффективно индуцирующими специфическую дифференцировку Th1 [97]. Проводятся исследования 1,25-дигидроксивитамина D3 в качестве добавки для усиления ответа с участием Treg-лимфоцитов посредством воздействия на толерогенные свойства ДК [98]. Новые исследования открывают огромное количество иммунных стимуляторов и методов сопряжения с аллергенами; однако исследования по доказательству концепции, а также крупные контролируемые клинические исследования еще предстоит выполнить [92, 93, 97, 98]. Другой подход включает использование аллергена, ковалентно связанного с углеводными частицами для воздействия на ДК с повышенной адъювантностью, или использование белка-переносчика, такого как домен PreS вируса гепатита В, связанного с 2 неаллергенными пептидами [99]. Также сообщалось о хорошем профиле безопасности, значимом снижении риска анафилаксии и улучшении индекса применения лекарственных препаратов неотложной помощи в случае использования комбинации АСИТ с модификаторами иммунного ответа, включая анти-IgE (омализумаб) [100, 101].
При лечении аллергического ринита и бронхиальной астмы подкожной и сублингвальной АСИТ показана эффективность, оцениваемая по уменьшению индексов симптомов и использования лекарственных препаратов, по улучшению качества жизни, а также индукции стойких болезнь-модифицирующих эффектов, согласно изменениям специфических иммунологических маркеров [64]. Продолжается работа по изучению новых путей введения, таких как внутрилимфатический и накожный [102]. Кроме того, осуществляется расширение cублингвальной иммунотерапии с включением других аллергенов в рамках рандомизированных исследований 3-й фазы с целью разработки новых препаратов, а также схем введения и мер по уменьшению продолжительности АСИТ [103, 104, 105]. Перспективами развития АСИТ являются дальнейшее изучение механизмов, разработка и регистрация высокоэффективных и безопасных лечебных аллергенов с целью повышения доступности качественного лечения для широкого круга пациентов, которым показана АСИТ.
Информация об источниках финансирования
Финансовой поддержки в настоящей статье не было.
Конфликт интересов
Авторы заявляют, что они не имеют конфликта интересов.
Литература
- Akdis M, Akdis CA. Mechanisms of allergen-specific immunotherapy. J Allergy Clin Immunol. 2007;(119):780-791. DOI: 10.1016/j.jaci.2007.01.022.
-
Akdis M. Healthy immune response to allergens: T-regulatory cells and more. Curr Opin Immunol. 2006;(18):738-744. DOI: 10.1016/j.coi.2006.06.003.
-
Larche M, Akdis CA, Valenta R. Immunological mechanisms of allergen-specific immunotherapy. Nat Rev Immunol. 2006;(6):761-771. DOI: 10.1038/nri1934.
-
Durham SR, Walker SM, Varga EV, Jacobson MR, O’Brien F, Noble W et al. Long-term clinical efficacy of grass-pollen immunotherapy. N Engl J Med. 1999;(341):468-475. DOI: 10.1056/NEJM199908123410702.
-
Vickery BP, Scurlock AM, Kulis M, Steele PH, Kamilaris J, Berglund JP et al. Sustained unresponsiveness to peanut in subjects who have completed peanut oral immunotherapy. J Allergy Clin Immunol. 2014;(133):468-475. DOI: 10.1016/j. jaci.2013.11.007.
-
Pajno GB, Barberio G, De Luca F, Morabito L, Parmiani S. Prevention of new sensitizations in asthmatic children monosensitized to house dust mite by specific immunotherapy. A six-year follow-up study. Clin Exp Allergy. 2001;(31):13921397. DOI: 10.1046/j.1365-2222.2001.01161.x.
-
Moller C, Dreborg S, Ferdousi HA, Halken S, Høst A, Jacobsen L et al. Pollen immunotherapy reduces the development of asthma in children with seasonal rhinoconjunctivitis (the PAT-study) J Allergy Clin Immunol. 2002;(109):251-256. DOI: 10.1067/mai.2002.121317.
-
Wang M, Takeda K, Shiraishi Y, Okamoto M, Dakhama A, Joetham A et al. Peanut-induced intestinal allergy is mediated through a mast cell-IgE-FceRI-IL-13 pathway. J Allergy Clin Immunol. 2010;(126):306-316. DOI: 10.1016/j. jaci.2010.05.017.
-
Berin MC, Shreffler WG. Th2 adjuvants: implications for food allergy. J Allergy Clin Immunol. 2008;(121):1311-1320. DOI: 10.1016/j.jaci.2008.04.023.
-
Chatila TA, Li N, Garcia-Lloret M, Kim HJ, Nel AE. T-cell effector pathways in allergic diseases: transcriptional mechanisms and therapeutic targets. J Allergy Clin Immunol. 2008;(121):812-823. DOI: 10.1016/j.jaci.2008.02.025.
-
Kang CM, Jang AS, Ahn MH, Shin JA, Kim JH, Choi YS et al. Interleukin-25 and interleukin-13 production by alveolar macrophages in response to particles. Am J Respir Cell Mol Biol. 2005;(33):290-296. DOI: 10.1165/rcmb.2005-0003OC.
-
Wang YH, Angkasekwinai P, Lu N, Voo KS, Arima K, Hanabuchi S et al. IL-25 augments type 2 immune responses by enhancing the expansion and functions of TSLP-DC-acti- vated Th2 memory cells. J Exp Med. 2007;(204):1837-1847. DOI: 10.1084/jem.20070406.
-
Dillon SR, Sprecher C, Hammond A, Bilsborough J, Rosenfeld-Franklin M, Presnell SR et al. Interleukin-31, a cytokine produced by activated T-cells, induces dermatitis in mice. Nat Immunol. 2004;(5):752-760. DOI: 10.1038/ni1084.
-
Bilsborough J, Leung DY, Maurer M, Howell M, Boguniewicz M, Yao L et al. IL-31 is associated with cutaneous lymphocyte antigen-positive skin homing T-cells in patients with atopic dermatitis. J Allergy Clin Immunol. 2006;(117):418425. DOI: 10.1016/j.jaci.2005.10.046.
-
Kakkar R, Lee RT. The IL-33/ST2 pathway: therapeutic target and novel biomarker. Nat Rev Drug Discov. 2008;(7):827-840. DOI: 10.1038/nrd2660.
-
Prefontaine D, Nadigel J, Chouiali F, Audusseau S, Semlali A, Chakir J et al. Increased IL-33 expression by epithelial cells in bronchial asthma. J Allergy Clin Immunol. 2010;(125):752754. DOI: 10.1016/j.jaci.2009.12.935.
-
Rank MA, Kobayashi T, Kozaki H, Bartemes KR, Squillace DL, Kita H. IL-33-activated dendritic cells induce an atypical TH2-type response. J Allergy Clin Immunol. 2009;(123):1047-1054. DOI: 10.1016/j.jaci.2009.02.026.
-
Romagnani S. Immunologic influences on allergy and the TH1/TH2 balance. J Allergy Clin Immunol. 2004;(113):395400. DOI: 10.1016/j.jaci.2003.11.025.
-
Finotto S, Neurath MF, Glickman JN, Qin S, Lehr HA, Green FH et al. Development of spontaneous airway changes consistent with human asthma in mice lacking T-bet. Science. 2002;(295):336-338. DOI: 10.1126/science.1065544.
-
Akkoc T, de Koning PJ, Ruckert B, Barlan I, Akdis M, Akdis CA. Increased activation-induced cell death of high IFN-g-producing Th1 cells as a mechanism of Th2 predominance in atopic diseases. J Allergy Clin Immunol. 2008;(121):652-658. DOI: 10.1016/j.jaci.2007.12.1171.
-
Trautmann A, Akdis M, Kleemann D, Altznauer F, Simon HU, Graeve T et al. T-cell-mediated Fas-induced keratinocyte apoptosis plays a key pathogenetic role in eczematous dermatitis. J Clin Invest. 2000;(106):25-35. DOI: 10.1172/ JCI9199.
-
Burgler S, Ouaked N, Bassin C, Basinski TM, Mantel PY, Siegmund K et al. Differentiation and functional analysis of human T(H)17 cells. J Allergy Clin Immunol. 2009;(123):588595. DOI: 10.1016/j.jaci.2008.12.017.
-
Zheng Y, Danilenko DM, Valdez P, Kasman I, Eastham-Anderson J, Wu J et al. Interleukin-22, a Th17 cytokine, mediates IL-23-induced dermal inflammation and acanthosis. Nature. 2007;(445):648-651. DOI: 10.1038/nature05505.
-
Park H, Li Z, Yang XO, Chang SH, Nurieva R, Wang YH et al. A distinct lineage of CD4 T-cells regulates tissue inflammation by producing interleukin-17. Nat Immunol. 2005;(6):11331141. DOI: 10.1038/ni1261.
-
Mangan PR, Harrington LE, O’Quinn DB, Helms WS, Bullard DC, Elson CO et al. Transforming growth factor-beta induces development of the Th17 lineage. Nature. 2006;(441):231-234. DOI: 10.1038/nature04754.
-
Harrington LE, Hatton RD, Mangan PR, Turner H, Murphy TL, Murphy KM et al. Interleukin 17-producing CD4+ effector T-cells develop via a lineage distinct from the T-helper type 1 and 2 lineages. Nat Immunol. 2005;(6):1123-1132. DOI: 10.1038/ni1254.
-
Makihara S, Okano M, Fujiwara T, Kariya S, Noda Y, Higaki T et al. Regulation and characterization of IL-17A expression in patients with chronic rhinosinusitis and its relationship with eosinophilic inflammation. J Allergy Clin Immunol. 2010;(126):397-400. DOI: 10.1016/j.jaci.2010.05.014.
-
Martin P, Gomez M, Lamana A, Matesanz Marín A, Cortés JR, Ramírez-Huesca M et al. The leukocyte activation antigen CD69 limits allergic asthma and skin contact hypersensitivity. J Allergy Clin Immunol. 2010;(126):355-365. DOI: 10.1016/j.jaci.2010.05.010.
-
Sergejeva S, Ivanov S, Lotvall J, Linden A. Interleukin-17 as a recruitment and survival factor for airway macrophages in allergic airway inflammation. Am J Respir Cell Mol Biol. 2005;(33):248-253. DOI: 10.1165/rcmb.2004-0213OC.
-
Hellings PW, Kasran A, Liu Z, Vandekerckhove P, Wuyts A, Overbergh L et al. Interleukin-17 orchestrates the granulocyte influx into airways after allergen inhalation in a mouse model of allergic asthma. Am J Respir Cell Mol Biol. 2003;(28):4250. DOI: 10.1165/rcmb.4832.
-
Bush KA, Farmer KM, Walker JS, Kirkham BW. Reduction of joint inflammation and bone erosion in rat adjuvant arthritis by treatment with interleukin-17 receptor IgG1 Fc fusion protein. Arthritis Rheum. 2002;(46):802-805. DOI: 10.1002/art.10173.
-
Rangachari M, Mauermann N, Marty RR, Dirnhofer S, Kurrer MO, Komnenovic V et al. T-bet negatively regulates autoimmune myocarditis by suppressing local production of interleukin 17. J Exp Med. 2006;(203):2009-2019. DOI: 10.1084/ jem.20052222.
-
Dardalhon V, Awasthi A, Kwon H, Galileos G, Gao W, Sobel RA et al. IL-4 inhibits TGF-}-induced Foxp3+ T-cells and, together with TGF-}, generates IL-9+ IL-10+ Foxp3- effector T-cells. Nat Immunol. 2008;(9):1347-1355. DOI: 10.1038/ ni.1677.
-
Veldhoen M, Uyttenhove C, van Snick J, Helmby H, Westendorf A, Buer J et al. Transforming growth factor-beta ‘repro- grams’ the differentiation of T-helper 2 cells and promotes an interleukin 9-producing subset. Nat Immunol. 2008;(9):13411346. DOI: 10.1038/ni.1659.
-
Nograles KE, Zaba LC, Shemer A, Fuentes-Duculan J, Cardinale I, Kikuchi T et al. IL-22-producing «T22» T-cells account for upregulated IL-22 in atopic dermatitis despite reduced IL-17-producing TH17 T-cells. J Allergy Clin Immu- nol. 2009;(123):1244-1252. DOI: 10.1016/j.jaci.2009.03.041.
-
Akdis CA, Akdis M. Mechanisms and treatment of allergic disease in the big picture of regulatory T-cells. J Allergy Clin Immunol. 2009;(123):735-746. DOI: 10.1016/j.jaci.2009.02.030.
-
Sugita K, Hanakawa S, Honda T, Kondoh G, Miyachi Y, Kabashima K et al. Generation of Helios reporter mice and an evaluation of the suppressive capacity of Helios+ regulatory T-cells in vitro. Exp Dermatol. 2015;(24):554-556. DOI: 10.1111/exd.12711.
-
Yamada T, Tongu M, Goda K, Aoi N, Morikura I, Fuchiwaki T et al. Sublingual immunotherapy induces regulatory function of IL-10-expressing CD4+CD25+FoxP3+ T-cells of cervical lymph nodes in murine allergic rhinitis model. J. Allergy. 2012;(2012):1-11. DOI: 10.1155/2012/490905.
-
Bacchetta R, Gambineri E, Roncarolo MG. Role of regulatory T-cells and FoxP3 in human diseases, Allergy Clin. Immunol. 2007;(120):227-235. DOI: 10.1016/j.jaci.2007.06.023.
-
Lai CS, Fisher SE, Hurst JA, Vargha-Khadem F, Monaco AP. A forkhead-domain gene is mutated in a severe speech and language disorder. Nature. 2001;(413):519-523. DOI: 10.1038/35097076.
-
Akdis M, Verhagen J, Taylor A, Karamloo F, Karagiannidis C, Crameri R et al. Immune responses in healthy and allergic individuals are characterized by a fine balance between aller- gen-specific T-regulatory 1 and T-helper 2 cells. J Exp Med. 2004;(199):1567-1575. DOI: 10.1084/jem.20032058.
-
Girtsman T, Jaffar Z, Ferrini M, Shaw P, Roberts K. Natural FoxP3+ regulatory T-cells inhibit Th2 polarization but are biased toward suppression of Th17-driven lung inflammation. J Leukoc Biol. 2010;(88):537-546. DOI: 10.1189/jlb.0110044.
-
Jaffar Z, Ferrini ME, Girtsman TA, Roberts K. Antigen-specific Treg regulate Th17-mediated lung neutrophilic inflammation, B-cell recruitment and polymeric IgA and IgM levels in the airways. Eur J Immunol. 2009;(39):3307-3314. DOI: 10.1002/eji.200939498.
-
Yang L, Ma QL, Yao W, Zhang Q, Chen H, Wang G et al. Relationship between the anti-inflammatory properties of salmeterol/fluticasone and the expression of CD4+CD25+FoxP3+ regulatory T-cells in COPD. Respir Res. 2011;(12):142. DOI: 10.1186/1465-9921-12-142.
-
Hori S, Nomura T, Sakaguchi S. Control of regulatory T-cell development by the transcription factor Foxp3. Science. 2003;(299):1057-1061. DOI: 10.1126/science.1079490.
-
Smith EL, Finney HM, Nesbitt AM, Ramsdell F, Robinson MK. Splice variants of human FOX P3 are functional inhibitors of human CD4 + T-cell activation. Immunology. 2006;(119):203-211. DOI: 10.1111/j.1365-2567.2006.02425.x.
-
Kaur G, Goodall JC, Jarvis LB, Gaston JSH. Characterisation of Foxp3 splice variants in human CD4 + and CD8+ T-cells – identification of Foxp3d7 in human regulatory T-cells. Mol Immunol. 2010;(48):321-332. DOI: 10.1016/j. molimm.2010.07.008.
-
Mailer RKW, Kirsten Falk K, Rotzschke O. Absence of leucine zipper in the natural FOX P3D2D7 isoform does not affect dimerization but abrogates suppressive capacity. PLoS ONE. 2009;(4):1-17. DOI: 10.1371/journal.pone.0006104.
-
Du J, Huang C, Zhou B, Ziegler SF. Isoform-specific inhibi- tion of RORa-mediated transcriptional activation by human FOX P3. J Immunol. 2008;(180):4785-4792. DOI: 10.4049/ jimmunol.180.7.4785.
-
Ichiyama K, Yoshida H, Wakabayashi Y, Chinen T, Saeki K et al. Foxp3 inhibits RORgt-mediated IL-17A mRNA transcription through direct interaction with RORgt. J Biol Chem. 2008;(283):17003-17008. DOI: 10.1074/jbc.m801286200.
-
Magg TH, Mannert J, Ellwart JW, Schmid I, Albert MH. Subcellular localization of FOX P3 in human regulatory and nonregulatory T-cells. Eur. J Immunol. 2012;(42):1627-1638. DOI: 10.1002/eji.201141838.
-
Митин АН, Литвина ММ, Митина ТА, Голенков АК, Ярилин АА. Анализ экспрессии молекулы foxp3 и ее изоформ CD4+ Т-клетками периферической крови при различных формах течения множественной миеломы методом проточной цитометрии Иммунология. 2014;(№4):215-219. [Mitin AN, Litvina MM, Mitina TA, Golenkov AK, Jarilin AA. Analiz jekspressii molekuly foxp3 i ee izoform CD4+ T-kletkami perifericheskoj krovi pri razlichnyh formah techenija mnozhestvennoj mielomy metodom protochnoj citometrii Immunologija. 2014;(№4):215-219. (In Russ.)].
-
Kucuksezer UC, Palomares O, Ruckert B, Jartti T, Puhakka T, Nandy A et al. Triggering of specific Toll-like receptors and proinflammatory cytokines breaks allergen-specific T-cell tolerance in human tonsils and peripheral blood. J Allergy Clin Immunol. 2013;(131):875-885. DOI: 10.1016/j. jaci.2012.10.051.
-
Palomares O, Rückert B, Jartti T, Kücüksezer UC, Puhakka T, Gomez E et al. Induction and maintenance of aller- gen-specific FOXP3+ Treg cells in human tonsils as potential first-line organs of oral tolerance. J Allergy Clin Immunol. 2012;(129):510-520. DOI: 10.1016/j.jaci.2011.09.031.
-
Jartti T, Palomares O, Waris M, Tastan O, Nieminen R, Puhakka T et al. Distinct regulation of tonsillar immune response in virus infection. Allergy. 2014;(69):658-667. DOI: 10.1111/ all.12396.
-
Mehta AK, Duan W, Doerner AM, Traves SL, Broide DH, Proud D et al. Rhinovirus infection interferes with induction of tolerance to aeroantigens through OX40 ligand, thymic stromal lymphopoietin, and IL-33. J Allergy Clin Immunol. 2016;(137):278-288. DOI: 10.1016/j.jaci.2015.05.007.
-
Van de Veen W, Stanic B, Yaman G, Wawrzyniak M, Söllner S, Akdis DG et al. IgG4 production is confined to human IL-10-producing regulatory B-cells that suppress antigen-specific immune responses. J Allergy Clin Immunol. 2013;(131):1204-1212. DOI: 10.1016/j.jaci.2013.01.014.
-
Stanic B, van de Veen W, Wirz OF, Rückert B, Morita H, Söllner S et al. IL-10-overexpressing B-cells regulate innate and adaptive immune responses. J Allergy Clin Immunol. 2014;(135):771-780. DOI: 10.1016/j.jaci.2014.07.041.
-
Bartemes KR, Kephart GM, Fox SJ, Kita H. Enhanced innate type 2 immune response in peripheral blood from patients with asthma. J Allergy Clin Immunol. 2014;(1340):671-678. DOI: 10.1016/j.jaci.2014.06.024.
-
Annunziato F, Romagnani C, Romagnani S. The 3 major types of innate and adaptive cell-mediated effector immunity. J Allergy Clin Immunol. 2015;(135):626-635. DOI: 10.1016/j. jaci.2014.11.001.
-
Jutel M, Agache I, Bonini S, Burks AW, Calderon M, Canonica W. International Consensus On (ICON) Allergy Immunotherapy (AIT) II: mechanisms, standardization and pharmacoeconomics. J Allergy Clin Immunol. 2016;(137):358-368. DOI: 10.1016/j.jaci.2015.12.1300.
-
Akdis CA, Akdis M. Mechanisms of allergen-specific immunotherapy and immune tolerance to allergens. WAO Journal. 2015;(8):17. DOI: 10.1186/s40413-015-0063-2.
-
Akdis M, Akdis CA. Mechanisms of allergen-specific immuno- therapy: multiple suppressor factors at work in immune tolerance to allergens. J Allergy Clin Immunol. 2014;(133):621-631. DOI: 10.1016/j.jaci.2013.12.1088.
-
Burks AW, Calderon MA, Casale T, Cox L, Demoly P, Jutel M et al. Update on allergy immunotherapy: American Academy of Allergy, Asthma & Immunology/European Academy of Allergy and Clinical Immunology/PRACTALL consensus report. J Allergy Clin Immunol. 2013;(131):1288-1296. DOI: 10.1016/j.jaci.2013.01.049.
-
Agache I, Sugita K, Morita H, Akdis M, Akdis CA. The complex type 2 endotype in allergy and asthma: from laboratory to bedside. Curr Allergy Asthma Rep. 2015;(15):29. DOI: 10.1007/s11882-015-0529-x.
-
Tarzi M, Klunker S, Texier C, Verhoef A, Stapel SO, Akdis CA et al. Induction of interleukin-10 and suppressor of cytokine signalling-3 gene expression following peptide immunotherapy. Clin Exp Allergy. 2006;(36):465-474. DOI: 10.1111/j.13652222.2006.02469.x.
-
Alexander C, Ying S, Kay A, Larche M. Fel d 1-derived T-cell peptide therapy induces recruitment of CD4+CD25+; CD4+ interferon-gamma + T-helper type 1 cells to sites of allergen-induced late-phase skin reactions in cat-allergic subjects. Clin Exp Allergy. 2005;(35):52-58. DOI: 10.1111/j.13652222.2005.02143.x.
-
Romano A, Torres MJ, Castells M, Sanz ML, Blanca M. Diagnosis and management of drug hypersensitivity reactions. J Allergy Clin Immunol. 2011;(127):S67-73. DOI: 10.1016/j. jaci.2010.11.047.
-
Jutel M, Akdis M, Akdis CA. Histamine, histamine receptors and their role in immune pathology. Clin Exp Allergy. 2009;(39):1786-1800. DOI: 10.1111/j.13652222.2009.03374.x.
- Meiler F, Zumkehr J, Klunker S, Ruckert B, Akdis CA, Akdis M. In vivo switch to IL-10-secreting T-regulatory cells in high dose allergen exposure. J Exp Med. 2008;(205):28872898. DOI: 10.1084/jem.20080193.
-
Novak N, Mete N, Bussmann C, Maintz L, Bieber T, Akdis M et al. Early suppression of basophil activation during allergen-specific immunotherapy by histamine receptor 2. J Allergy Clin Immunol. 2012;(130):1153-1158. DOI: 10.1016/j. jaci.2012.04.039.
-
Ferstl R, Frei R, Schiavi E, Konieczna P, Barcik W, Ziegler M et al. Histamine receptor 2 is a key influence in immune responses to intestinal histaminesecreting microbes. J Allergy Clin Immunol. 2014;(134):744-746. DOI: 10.1016/j. jaci.2014.04.034.
-
Shamji MH, Layhadi JA, Scadding GW, Cheung DK, Calderon MA, Turka LA et al. Basophil expression of diamine oxidase: A novel biomarker of allergen immunotherapy response. J Allergy Clin Immunol. 2015;(135):913-921. DOI: 10.1016/j. jaci.2014.09.049.
-
Harvima IT, Levi-Schaffer F, Draber P, Friedman S, Polakovicova I, Gibbs BF et al. Molecular targets on mast cells and basophils for novel therapies. J Allergy Clin Immunol. 2014;(134):530-544. DOI: 10.1016/j.jaci.2014.03.007.
-
Kaczorowski M, Jutel M. Human T-regulatory cells: on the way to cognition. Arch Immunol Ther Exp. 2013;(61):229-236. DOI: 10.1007/s00005-013-0217-2.
-
Jutel M, Akdis CA. Immunological mechanisms of allergen-specific immunotherapy. Allergy. 2011;(66):725-732. DOI: 10.1111/j.1398-9995.2011.02589.x.
-
Suarez-Fueyo A, Ramos T, Galan A, Jimeno L, Wurtzen PA, Marin A et al. Grass tablet sublingual immunotherapy downregulates the TH2 cytokine response followed by regulatory T-cell generation. J Allergy Clin Immunol. 2014;(133):130138. DOI: 10.1016/j.jaci.2013.09.043.
-
Lou W, Wang C, Wang Y, Han D, Zhang L. Responses of CD4+CD25+ Foxp3+ and IL-10-secreting type I T-regulatory cells to cluster-specific immunotherapy for allergic rhinitis in children. Pediatr Allergy Immunol. 2011;(23):141-150. DOI: 10.1111/j.1399-3038.2011.01249.x.
-
Mobs C, Ipsen H, Mayer L, Slotosch C, Petersen A, Wurtzen PA et al. Birch pollen immunotherapy results in longterm loss of Bet v 1-specific TH2 responses, transient TR1 activation, and synthesis of IgE-blocking antibodies. J Allergy Clin Immunol. 2012;(130):1108-1116. DOI: 10.1016/j. jaci.2012.07.056.
-
Radulovic S, Jacobson MR, Durham SR, Nouri-Aria KT. Grass pollen immunotherapy induces Foxp3-expressing CD4+CD25+ cells in the nasal mucosa. J Allergy Clin Immunol. 2008;(121):1467-1472. DOI: 10.1016/j. jaci.2008.03.013.
-
81. Meiler F, Klunker S, Zimmermann M, Akdis CA, Akdis M. Distinct regulation of IgE, IgG4 and IgA by T-regulatory cells and toll-like receptors. Allergy. 2008;(63):1455-1463. DOI: 10.1111/j.1398-9995.2008.01774.x.
-
De Wit J, Jorritsma T, Makuch M, Remmerswaal EB, Klaasse Bos H, Souwer Y et al. Human B-cells promote T-cell plasticity to optimize antibody response by inducing coexpression of T(H)1/T(FH) signatures. J Allergy Clin Immunol. 2015;(135):1053-1060. DOI: 10.1016/j.jaci.2014.08.012.
-
Wachholz PA, Durham SR. Mechanisms of immunotherapy: IgG revisited. Curr Opin Allergy Clin Immunol. 2004;(4):313318. DOI: 10.1097/01.all.0000136753.35948.c0.
-
Van der Neut Kolfschoten M, Schuurman J, Losen M, Bleeker WK, Martinez-Martinez P, Vermeulen E et al. Anti-inflammatory activity of human IgG4 antibodies by dynamic Fabarm exchange. Science. 2007;(317):1554-1557. DOI: 10.1126/ science.1144603.
-
Aalberse RC, Schuurman J. IgG4 breaking the rules. Immunology. 2002;(105):9-19. DOI: 10.1046/j.00192805.2001.01341.x.
-
Gold MJ, Antignano F, Halim TY, Hirota JA, Blanchet MR, Zaph C et al. Group 2 innate lymphoid cells facilitate sensitization to local, but not systemic, TH2-inducing allergen exposures. J Allergy Clin Immunol. 2014;(133):1142-1148. DOI: 10.1016/j.jaci.2014.02.033.
-
Nagakumar P, Denney L, Fleming L, Bush A, Lloyd CM, Saglani S. Type 2 innate lymphoid cells in induced sputum from children with severe asthma. J Allergy Clin Immunol. 2016;(137):624-626. DOI: 10.1016/j.jaci.2015.06.038.
-
Lao-Araya M, Steveling E, Scadding GW, Durham SR, Shamji MH. Seasonal increases in peripheral innate lymphoid type 2 cells are inhibited by subcutaneous grass pollen immunotherapy. J Allergy Clin Immunol. 2014;(134):1193-1195. DOI: 10.1016/j.jaci.2014.07.029.
-
Shamji MH, Kappen JH, Akdia M, Jensen-Jarolim E, Knol EF, Kleine-Tebbe J et al. Biomarkers for monitoring clinical efficacy of allergen immunotherapy for allergic rhinoconjunctivitis and allergic asthma: an EAACI Position Paper. Allergy. 2017;(72):1156-1173. DOI: 10.1111/all.13138.
-
Pfaar O, Demoly P, Gerth van Wijk R, Bonini S, Bousquet J, Canonica GW et al. EAACI. Recommendations for the standardization of clinical outcomes used in allergen immunotherapy trials for allergic rhinoconjunctivitis: an EAACI Position Paper. Allergy. 2014;(69):854-867. DOI: 10.1111/ all.12383.
-
Casale TB, Stokes JR. Immunotherapy: what lies beyond. J Allergy Clin Immunol. 2014;(133):612-619. DOI: 10.1016/j. jaci.2014.01.007.
-
Jutel M, Akdis CA. Novel immunotherapy vaccine development. Curr Opin Allergy Clin Immunol. 2014;(14):557-563. DOI: 10.1097/aci.0000000000000121.
-
Sharma P, Gaur SN, Arora N. Immunotherapy with B-cell epitopes ameliorates inflammatory responses in Balb/c mice. Clin Exp Immunol. 2014;(179):128-136. DOI: 10.1111/ cei.12442.
-
Jones SM, Burks AW, Dupont C. State of the art on food allergen immunotherapy: oral, sublingual, and epicutaneous. J Allergy Clin Immunol. 2014;(133):318-323. DOI: 10.1016/j. jaci.2013.12.1040.
-
Jutel M, Solarewicz-Madejek K, Smolinska S. Recombinant allergens: the present and the future. Hum Vaccin Immuno- ther. 2012;(8):1534-1543. DOI: 10.4161/hv.22064.
-
Linhart B, Focke-Tejkl M, Weber M, Narayanan M, Neubauer A, Mayrhofer H et al. Molecular evolution of hypoallergenic hybrid proteins for vaccination against grass pollen allergy. J Immunol. 2015;(194):4008-4018. DOI: 10.4049/ jimmunol.1400402.
-
Fili L, Cardilicchia E, Maggi E, Parronchi P. Perspectives in vaccine adjuvants for allergen-specific immunotherapy. Immunol Lett. 2014;(161):207-210. DOI: 10.1016/j.imlet.2013.12.011.
-
Grundstrom J, Neimert-Andersson T, Kemi C, Nilsson OB, Saarne T, Andersson M et al. Covalent coupling of vitamin D3 to the major cat allergen Fel d 1 improves the effects of allergen-specific immunotherapy in a mouse model for cat allergy. Int Arch Allergy Immunol. 2012;(157):136-146. DOI: 10.1159/000327546.
-
Linhart B, Narayanan M, Focke-Tejkl M, Wrba F, Vrtala S, Valenta R. Prophylactic and therapeutic vaccination with carrier-bound Bet v 1 peptides lacking allergen-specific T-cell epitopes reduces Bet v 1-specific T-cell responses via blocking antibodies in a murine model for birch pollen allergy. Clin Exp Allergy. 2014;(44):278-287. DOI: 10.1111/cea.12216.
-
Schneider LC, Rachid R, LeBovidge J, Blood E, Mittal M, Umetsu DT. A pilot study of omalizumab to facilitate rapid oral desensitization in high-risk peanutallergic patients. J Allergy Clin Immunol. 2013;(132):1368-1374. DOI: 10.1016/j. jaci.2013.09.046.
-
Larenas-Linnemann D, Wahn U, Kopp M. Use of omalizumab to improve desensitization safety in allergen immunotherapy. J Allergy Clin Immunol. 2014;(133):937-937. DOI: 10.1016/j.jaci.2013.12.1089.
-
Kundig TM, Johansen P, Bachmann MF, Cardell LO, Senti G. Intralymphatic immunotherapy: time interval between injections is essential. J Allergy Clin Immunol. 2014;(133):930-931. DOI: 10.1016/j.jaci.2013.11.036.
-
Creticos PS, Esch RE, Couroux P, Gentile D, D’Angelo P, Whitlow B et al. Randomized, double-blind, placebo-controlled trial of standardized ragweed sublingual-liquid immunotherapy for allergic rhinoconjunctivitis. J Allergy Clin Immunol. 2014;(133):751-758. DOI: 10.1016/j.jaci.2013.10.041.
-
Patel P, Holdich T, Fischer von Weikersthal-Drachenberg KJ, Huber B. Efficacy of a short course of specific immunotherapy in patients with allergic rhinoconjunctivitis to ragweed pollen. J Allergy Clin Immunol. 2014;(133):121-129. DOI: 10.1016/j. jaci.2013.05.032.

